общая теория макроскопического описания
неравновесных процессов (См.
Неравновесные процессы)
. Она называется также неравновесной термодинамикой или термодинамикой необратимых
процессов.
Классическая
термодинамика изучает термодинамические (обратимые) процессы. Для
неравновесных процессов она устанавливает лишь неравенства, которые указывают возможное направление этих
процессов. Основная задача Т. н. п. - количественное изучение
неравновесных процессов, в частности определение их скоростей в зависимости от внешних условий. В Т. н. п. системы, в которых протекают неравновесные процессы, рассматриваются как непрерывные среды, а их параметры состояния - как полевые переменные, то есть непрерывные функции координат и времени. Для макроскопического описания
неравновесных процессов применяют следующий метод: систему представляют состоящей из элементарных объёмов, которые всё же настолько велики, что содержат очень большое число молекул.
Термодинамическое состояние каждого выделенного элементарного объёма характеризуется температурой, давлением и др. параметрами, применяемыми в термодинамике равновесных
процессов, но зависящими от координат и времени. Количественное описание
неравновесных процессов при таком методе заключается в составлении уравнений баланса для элементарных объёмов на основе законов сохранения массы, импульса и энергии, а также уравнения баланса энтропии и феноменологических уравнений рассматриваемых
процессов. Методы Т. н. п. позволяют сформулировать для
неравновесных процессов 1-е и 2-е начала термодинамики; получить из общих принципов, не рассматривая деталей механизма молекулярных взаимодействий, полную систему уравнений переноса, то есть уравнения гидродинамики, теплопроводности и диффузии для простых и сложных систем (с химическими реакциями между компонентами, с учётом электромагнитных сил и т. д.).
Закон сохранения массы в Т. н. п. Для многокомпонентной системы скорость изменения массы
k-й компоненты в элементарном объёме равна потоку массы в этот объём
ρkυk, где
ρk - плотность, а
υk - скорость компоненты. Поток в бесконечно малый элемент объёма, приходящийся на единицу объёма, есть
Дивергенция с обратным знаком, следовательно, уравнение баланса массы
к-й компоненты имеет вид
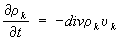 .
. Для суммарной плотности
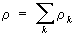
закон сохранения имеет аналогичный вид
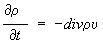 ,
, где υ
- гидродинамическая скорость среды, зависящая от координат и времени. Для концентрации какой-либо компоненты
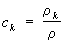
закон сохранения массы
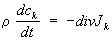
позволяет определить диффузионный поток
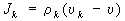
(здесь
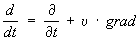
- полная производная по времени).
Закон сохранения импульса в Т. н. п. Изменение импульса элементарного объёма может происходить за счёт сил, вызванных градиентом внутренних напряжений в среде
Pαβ, и внешних сил
Fk. Закон сохранения импульса, примененный к гидродинамической скорости, позволяет получить основные уравнения гидродинамики
(Навье - Стокса уравнения)
:
(1)
где υα - декартовы компоненты скорости υ, а Рβα - тензор напряжений.
Закон сохранения энергии для элементарных объёмов представляет собой
Первое начало термодинамики в Т. н. п. Здесь приходится учитывать, что полная удельная энергия складывается из удельной кинетической, удельной потенциальной энергии в поле сил
Fk и удельной внутренней энергии
u, которая представляет собой энергию теплового движения молекул и среднюю энергию молекулярных взаимодействий. Для
u получается уравнение баланса, аналогичное (1), из которого следует, что скорость изменения плотности импульса на одну частицу
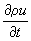
определяется дивергенцией плотностей потоков внутренней энергии
ρuυ и теплоты
Jq, а также работой внутренних напряжений
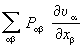
и внешних сил
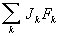
.
Уравнение баланса энтропии. В Т. н. п. принимается, что энтропия элементарного объёма s (локальная энтропия) является такой же функцией от внутренней энергии u, удельного объёма υ = 1/ρ и концентрации ck, как и в состоянии полного равновесия, и, следовательно, для неё справедливы обычные термодинамические равенства. Эти положения вместе с законами сохранения массы, импульса и энергии позволяют найти уравнение баланса энтропии:
(2)
где
σ - локальное
Производство энтропии на единицу объёма в единицу времени,
Js - плотность потока энтропии, который выражается через плотности теплового потока, диффузионного потока и ту часть тензора напряжений, которая связана с неравновесными процессами (то есть через тензор вязких напряжений
Пαβ).
Энтропия (в отличие от массы, энергии и импульса) не сохраняется, а возрастает со временем в элементе объёма вследствие необратимых
процессов со скоростью
σ; кроме того, энтропия может изменяться вследствие втекания или вытекания её из элемента объёма, что не связано с необратимыми процессами. Положительность производства энтропии (
σ > 0) выражает в Т. н. п. закон возрастания энтропии (см.
Второе начало термодинамики)
. Производство энтропии σ определяется только необратимыми процессами (например, диффузией, теплопроводностью, вязкостью) и равно
, (3)
где Ji - поток (например, диффузионный поток Jk, тепловой поток Jq, тензор вязких напряжений Пαβ), a Xi - сопряжённые им термодинамические силы, то есть градиенты термодинамических параметров, вызывающих отклонение от равновесного состояния. Для получения в Т. н. п. замкнутой системы уравнений, описывающих неравновесные процессы, потоки физических величин при помощи феноменологических уравнений выражают через термодинамических силы.
Феноменологические уравнения. Т. н. п. исходит из того, что при малых отклонениях системы от термодинамического равновесия возникающие потоки линейно зависят от термодинамической силы и описываются феноменологическими уравнениями типа
(4)
где
Lik - кинетический (феноменологический) коэффициент, или коэффициент переноса. В прямых процессах термодинамическая сила
Xk вызывает поток
Jk, например градиент температуры вызывает поток теплоты (теплопроводность), градиент концентрации - поток вещества (диффузию), градиент скорости - поток импульса (определяет вязкость), электрическое поле - электрический ток (электропроводность). Такие процессы характеризуются кинетическим коэффициентом, пропорциональными коэффициентами теплопроводности, диффузии, вязкости, электропроводности. Последние обычно также называются кинетическим коэффициентом или коэффициентом переноса. Термодинамическая сила
Xk может вызывать также поток
Ji, при
i ≠
k; например, градиент температуры может вызывать поток вещества в многокомпонентных системах
(Термодиффузия, или Соре эффект), а градиент концентрации - поток теплоты (диффузионный термоэффект, или
Дюфура эффект)
. Такие процессы называются перекрёстными или налагающимися эффектами; они характеризуются коэффициентами
Lik с
i ≠
k. С учётом феноменологических уравнений производство энтропии равно
(5)
В стационарном состоянии величина σ минимальна при заданных внешних условиях, препятствующих достижению равновесия
(Пригожина теорема)
. В состоянии равновесия термодинамического (См.
Равновесие термодинамическое)
σ = 0. Одной из основных теорем Т. н. п. является
Онсагера теорема, устанавливающая свойство симметрии кинетических коэффициентов в отсутствие внешнего магнитного поля и вращения системы как целого:
Lik =
Lki. Т. н. п. в гетерогенных системах. В рассмотренных выше примерах термодинамические параметры были непрерывными функциями координат. Возможны неравновесные системы, в которых термодинамические параметры меняются скачком (прерывные, гетерогенные системы (См.
Гетерогенная система))
, например газы в сосудах, соединённых капилляром или мембраной. Если температуры
Т и химические потенциалы (См.
Химический потенциал)
μ газов в сосудах не равны (
T1 >
T2 и
μ1 >
μ2), то термодинамические силы
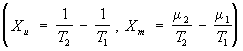
вызывают потоки массы и энергии (
Jm = L11Xm + L12Xu, Ju = L21Xm +
L22Xu)
между сосудами. Т. н. п. в этом случае объясняет возникновение термомолекулярной разности давлений и термомолекулярного эффекта. В этом примере потоки и термодинамические силы -
Скаляры
; такие процессы называются скалярными. В процессах диффузии, теплопроводности, термодиффузии и эффекте Дюфура потоки и термодинамические силы -
Векторы
, поэтому они называются векторными процессами. В вязком потоке, при сдвиговой вязкости, термодинамические силы и потоки -
Тензоры
, поэтому этот
процесс называется тензорным. В изотропной среде линейные соотношения могут связывать термодинамические силы и потоки лишь одинаковой тензорной размерности (теорема П.
Кюри)
, в этом случае феноменологические уравнения сильно упрощаются.
Лит.: Гроот С. Р. де, Мазур П., Неравновесная термодинамика, пер. с англ., М., 1964; Пригожин И., Введение в термодинамику необратимых процессов, пер. с англ., М., 1960; Денбиг К., Термодинамика стационарных необратимых процессов, пер. с англ., М., 1954; Хаазе Р., Термодинамика необратимых процессов, пер. с нем., М., 1967; Дьярмати И., Неравновесная термодинамика. Теория поля и вариационные принципы, пер. с англ., М., 1974.
Д. Н. Зубарев.
![RL-цепочке]] RL-цепочке]]](https://commons.wikimedia.org/wiki/Special:FilePath/Transient in RL-circuit.gif?width=200)
